Як почати розбиратись, які ліки ефективні, а які ні?
“Епідемія фуфломіцинів” – десь так можна описати, те що відбувається зараз в українській медицині.
Кількість призначень неефективних лікарських засобів, єдиною метою яких є викачування грошей, перевищує будь-які розумні межі, пацієнти ж витрачають на них останні кошти.
І хоча про цю проблему все частіше говорять і намагаються з нею боротись, але суттєвих результатів поки що не видно.
Описувати можливі законодавчі зміни для виправлення ситуації не має сенсу, бо рецепт відомий і потрібна лише політична воля.
Тому пропоную не чекаючи на політичні рішення спробувати розібратись у тому, які ліки мають доведену ефективність, а які ні.
Можливо, найпростіше було б написати декілька простих лайфхаків, але використання їх без розуміння базових речей не допоможе і швидко забудеться, тому розпишу все більш детально.
Хочу одразу попередити, що ця стаття не є посібником по самолікуванню, але вона має навчити задавати питання лікарям, фармацевтам та іншим спеціалістам від медицини.
Спочатку спробуємо розібратись з тим, як же ліки стають ліками, бо без цього доволі важко говорити про оцінку їх ефективності.
Існує два основні підходи у створенні ліків.
Перший – йде шляхом пошуку захворювання, яке зможе лікувати вже відома речовина (зазвичай це речовини, що були виділені з рослин, бактерій чи інших організмів).
Другий – йде шляхом знаходження речовини, що буде лікувати конкретне захворювання (штучно синтезовані речовини).
На сьогодні більшість ліків розробляються за другим шляхом, але не варто відкидати й перший, бо він вже дозволив знайти багато ефективних ліків.
Наприклад, така речовина як рапаміцин була виділена з бактерії Streptomyces hygroscopicus, яка була знайдена у зразках ґрунту з острова Пасхи. І тільки після років досліджень в неї було виявлено імуносупресивну дію, внаслідок інгібування протеїнкінази mTOR. І тепер рапаміцин застосовується для профілактики відторгнення органів після трансплантації. І не факт, що ця молекула колись була би створена людиною.
| Як почати розбиратись, які ліки ефективні, а які ні? |
| Рапаміцин або cіролімус. Джерело |
З іншого боку, людина створила речовини, що не існують у природі, наприклад, інфліксімаб – химерне моноклональне антитіло (генетичний код отриманих антитіл є комбінацією ДНК миші та людини), яке вибірково зв’язується з цитокіном ФНП-α.
Цей препарат зараз застосовується для лікування хвороби Крона, псоріазу та ряду інших захворювань, а за відкриття принципу створення такого типу речовин у 1984 році Сезар Мільштейн, Георг Келер, Нільс Єрне отримали Нобелівську премію.
| Як почати розбиратись, які ліки ефективні, а які ні? |
| Інфліксімаб. Джерело |
Але ми повернемось до процесу розробки ліків. Фармацевтичні компанії, приймаючи рішення про розробку лікарських засобів, відштовхуються від наявної наукової експертизи та бізнесової складової. Після того, як менеджмент обирає певне захворювання, вчені досліджують наявну інформацію про захворювання та починають пошук біологічних мішеней, вплив на які, на їх думку, дозволить коригувати захворювання (це можуть бути білки, ферменти, іоні канали тощо).
На даний час існує більше 1400 затверджених у США та ЄС діючих речовин, але взаємодіють вони лише з 324 мішенями.
Будь-який препарат, має мішень або декілька мішеней, з якими він взаємодіє. Наразі вже відомі основні мішені та механізми дії майже всіх лікарських засобів, що були відкриті людством у минулому.
Лікарський засіб не може просто так взяти і знизити тиск, але він може пригнітити дію ангіотензинперетворюючого ферменту, який в свою чергу буде менше перетворювати ангіотензин I в ангіотензин II, і таким чином зменшиться його судинозвужувальна дія і відбудеться розширення судин, що призведе до зниження тиску – і це є механізмом дії інгібіторів АПФ (такі препарати як, еналаприл, лізиноприл, раміприл).
Таким чином, якщо у препарату немає мішені та механізму дії – його ефективність сумнівна, а деякі винятки лише підтверджують загальне правило.
Після того, як вчені обрали потенційну мішень, на яку вони хочуть впливати, необхідно знайти речовини, що потенційно можуть це зробити. Для цього розробляються спеціальні банки хімічних речовин, що містять мільйони молекул.
Молекули спершу тестують за допомогою комп’ютерного моделювання, а вже потім перспективні молекули перевіряються на спеціальних біохімічних та клітинних моделях з застосуванням різних методик (радіологічних, електрофізичних, імуноферментних, генетичних та інших) і таким чином визначаються ті молекули, що мають впливати на мішені.
Після цього значно меншу кількість відібраних речовин тестують вже на спеціально розроблених тваринних моделях, які дозволяють якомога точніше імітувати захворювання, адже перебіг захворювань у людей і тварин різний або взагалі тварини не хворіють людськими захворюваннями.
Наприклад, для моделювання муковісцидозу була створена спеціальна генетично модифікована лінія свиней, а для дослідження гіпертонічної хвороби – лінія спонтанно гіпертензивних щурів.
Раніше ж дослідження проводилися на звичайних домашніх мишах, аж поки у 1906 році у Wistar Institute не була створена перша стандартизована лінія щурів Wistar, і наразі більше 50% лабораторних щурів є їх нащадками.
| Як почати розбиратись, які ліки ефективні, а які ні? |
| Трансгенні миші, що експресують ген підсиленого зеленого флуоресцентного білка (eGFP). Всі бажаючі можуть побачити їхпід час проведення Днів науку в Інституті фзіологіі ім. Богомольця НАН України або в Інституті молекулярної біології НАН України. Джерело |
Після проведення доклінічних досліджень на щонайменше двох видах тварин і отримання позитивних результатів відносно ефективності та безпечності починається етап дослідження на людях – клінічні дослідження.
Найперше документально засвідчене клінічне випробування було проведено у 1747 році, шотландським лікарем Джеймсом Ліндтом, який під час пошуку засобу для лікування та попередження цинги (нестача вітаміну С) розділів 12 моряків зі симптомами цинги на 6 груп і дав їм наступні речовини: сидр, розведену сірчану кислоту, оцет, морську воду, суміш декількох продуктів (в тому числі мускатного горіха і часнику) та апельсини з лимоном.
Вже за тиждень морякам, що отримували цитрусові стало значно краще. Таким чином, так і не дізнавшись причини цинги, він знайшов ефективний спосіб її лікування.
Сучасні клінічні дослідження починаються спершу на декількох десятках здорових добровольців, які отримують за це гроші (на інших фазах участь безкоштовна), і на яких перевіряють безпечність препарату, дозування та деякі інші фармакологічні показники.
У разі підтвердження безпечності переходять до фази 2 клінічних досліджень, коли відбувається обмежене дослідження ефективності та побічних ефектів на декількох сотнях хворих.
Після цього виробники переходять до фази 3 клінічних досліджень, коли залучається вже велика кількість пацієнтів, що може сягати кількох тисяч.
Такі дослідження проводяться відразу у багатьох країнах. За даними порталу clinicaltrials.gov в 2016 році у США розпочалося більше 8161 клінічних досліджень різних фаз, в Польщі – 359, в Україні лише 82 міжнародних клінічних дослідження (з локальними менше 200).
“Золотим стандартом” для сучасних досліджень є рандомізовані, подвійно-сліпі, плацебо-контрольовані дослідження – це означає, що існує щонайменше дві групи порівняння (плацебо або звичайна терапія та експериментальне лікування), в одну з яких пацієнт потрапляє випадково і ніхто не знає, в яку з цих груп він потрапив.
Це дозволяє усунути суб’єктивні та/або несвідомі упередження учасників дослідження.
Вперше таке дослідження було проведено у 1948 році під час випробування ефективності лікування стрептоміцином хворих на туберкульоз.
Сучасні стандарти для досліджень виникли не відразу.
Одним з найбільших викликів для клінічних досліджень є дослідження безпечності. До 1937 року не існувало настанов та вимог для дослідження безпечності лікарських засобів.
Перші зміни були зумовлені трагедією, що сталась через те, що до засобу для лікування стрептококової інфекцію Elixir sulfanilamide додали діетиленгліколь і це спричинило 107 смертей в США.
У 1961 році сталася талідомідова трагедія, коли через снодійний засіб народилось більше 10000 дітей з каліцтвами кінцівок. Причиною ж було те, що вчені хибно вважали, що плацентарний бар’єр між матір’ю та дитиною забезпечує достатній захист та не пропускає хімічні речовини і тому дослідження безпечності для плоду на тваринах не проводилися.
| Як почати розбиратись, які ліки ефективні, а які ні? |
| Дефект ступні через застосування талідаміду. Джерело |
Окрім цього був ще ряд інших трагедій і кожна з них зумовлювала посилення та вдосконалення регуляторних вимог до безпечності та ефективності лікарських засобів.
У разі успішного завершення декількох клінічних досліджень фази 3, фармацевтичні виробники подають документи на розгляд до регуляторних органів, в Європі це European Medicines Agency, в США це Food and Drug Administration (відділ, що займається питанням реєстрації нових ліків та має бюджет більше 290 млн доларів США), а в Україні це Державний експертний центр МОЗ України.
Загальний же науково-дослідний бюджет фармацевтичних виробників склав більше 154 млрд доларів США у 2016 році не враховуючи витрат на фундаментальні дослідження, що фінансуються з інших джерел. Такі витрати дозволяють кожного року реєструвати близько 50 нових лікарських засобів у США та ЄС, а вартість розробки нового лікарського препарату складає більше 2 млрд долларів США.
Варто зазначити, що нові лікарські засоби отримують патентний захист, тривалість якого залежить від країни та інших умов, але в середньому складає 20 років.
Саме за цей час виробники мають змогу повернути вкладені інвестиції та заробити. Після закінчення цього терміну, всі інші фармацевтичні виробники також отримують право виробляти ліки з тією ж діючою речовиною, такі ліки називаються дженериками.
Сподіваюсь, тепер ви розумієте, наскільки складний процес створення інноваційного лікарського засобу з доведеною ефективністю та безпечністю. І тому коли, хтось каже, що можливо “у гаражі” розробити панацею, то це змушує замислитись чи не шахрай або дурень перед вами.
Яка ж ситуація в Україні?
Для того, щоб лікарський засіб потрапив до аптечної мережі він має пройти експертизу реєстраційного досьє в Державному експертному центрі МОЗ України і отримати реєстраційне посвідчення.
Інформація, що міститься в досьє має підтверджувати, зокрема, ефективність та безпечність лікарського засобу. Ця інформація є комерційною таємницею, тому сторонньому спостерігачу неможливо оцінити вмотивованість видачі реєстраційного посвідчення.
За свідченнями залучених у цей процес професіоналів контроль за цією процедурою в останні роки значно посилився, але є сила силенна реєстраційних посвідчень, що були видані в минулому сумнівним лікарським засобам.
Наразі в Україні зареєстровано в якості ліків багато речовин, що не мають такого ж статусу в країнах ЄС та США і в кращому разі фігурують там як дієтична добавка.
З топ-30 найбільш популярних ліків в Україні за підсумками 2016 року – 11 лікарських засобів (за діючою речовиною) не продаються в країнах ЄС та США.
Можливо, європейці та американці не потребують таких “ефективних” ліків або ж ми неефективно витрачаємо ті мізерні кошти, що в нас є?
Загальний об’єм фармацевтичного ринку в Україні більше 50 млрд грн, а частка ліків, що не мають доведеної ефективності таким чином складає близько третини. Це означає, що десь 16 млрд грн витрачається фактично без користі для здоров’я пацієнтів.
| Як почати розбиратись, які ліки ефективні, а які ні? |
| ТОП-30 лікарських засобів за даними газети “Аптека“ |
Чому ж сумнівні лікарські засоби настільки популярні?
Причини цього можуть бути різні.
По-перше, фармацевтичні виробники можуть сплачувати лікарям за лояльність до їх препаратів матеріальними або іншими благами.
Для того, щоб зрозуміти масштаби цього явища, треба чесно визнати, що коли консультація лікаря безкоштовна або коштує “коробку цукерок”, то зацікавити лікарів призначати ті чи інші ліки (які коштують сотні і тисячі гривень) дуже просто.
По-друге, низька якість базової та післядипломної медичної освіти робить лікарів надзвичайно “вразливими” перед багатотисячною армією медичних представників, які кожного дня намагаються переконати 186 тисяч лікарів в ефективності їх препаратів.
Окрім цього, українські лікарі майже не читають англомовну літературу, в той час, коли більшість вітчизняної є “джинсою”. Тому склалася ситуація, коли медичну інформацію лікарі отримують не з незалежних джерел, а виключно від фармацевтичних компаній.
По-третє, шалений брак довіри до лікарів стимулює пацієнтів до самолікування за допомогою інтернету та порад працівників аптек, які мають виконати план продажів. Додатково свою справу робить і телевізійна реклама, на яку у 2015 році було витрачено 7,2 млрд грн.
Загалом причиною цієї ситуації є інституційна слабкість, в розвинутих країнах між лікарем та пацієнтом завжди є посередник, що сплачує лікування і контролює видатки.
Це можуть бути страхові компанії або інші інституції, що керуються певними стандартами лікування.
Проте в Україні більшу частину ліків пацієнти купляють за власний кошт, і тому не маючи спеціальних знань, вони вимушені довіряти лікарям.
Спробуємо розібратися у тому, з яких джерел можна отримати максимально об’єктивну інформацію про ефективність ліків.
Кожен лікарський засіб, що продається в аптеці має дві назви – торгівельне найменування (бренд), яке дає виробник і міжнародне непатентоване найменування (МНН), що характеризую діючу речовину.
До прикладу, в Україні зареєстровано більше 50 препаратів з різними торгівельними найменуваннями, що містять одну й ту саму діючу речовину – bisoprolol. І саме за діючою речовиною (МНН) ми будемо досліджувати ліки.
Для того, щоб дізнатися МНН треба скористатися Державним реєстром лікарських засобів, де знаючи торгівельне найменування можна знайти МНН. Цю інформацію можна також знайти в інструкції та на інших інтернет-порталах.
Загальна кількість МНН зараз становить приблизно 7000 найменувань і зростає з кожним роком. Тому якщо лікарський засіб не має МНН, то одразу викликають великі сумніви в доцільності його застосування.
Треба зазначити, що МНН не надається рослинним, гомеопатичним препаратам, хімічним сполукам (наприклад, acetic acid) та лікам, що давно використовуються та добре відомі під власними назвами (наприклад, morphine, codeine).
Тепер перейдемо до найцікавішого.
Давайте проаналізуємо відомі діючі речовини, наприклад, amitriptyline у лікуванні хворих з депресією та umifenovir (раніше відомий під однією з торгівельних назв як “Арбідол”) для лікування хворих на грип.
1. Як ви дізналися вище, найжорсткіша система оцінки ефективності та безпечності ліків у США та ЄС.
Тому спочатку дізнаємось чи зареєстровані там вказані лікарські засоби. Для цього можна виконати пошук на сайтах регуляторних органів FDA та EMA, або ж просто зайти на сайт-агрегатор www.drugbank.ca і виконати пошук там.
Як можна побачити амітриптілін має профіль на сайті DrugBank та позначку “approved”, що означає, що він дозволений до застосування в США та/або ЄС.
В свою чергу лікарські засоби, що містять уміфеновір не дозволені до застосування в США та ЕС.
| Як почати розбиратись, які ліки ефективні, а які ні? |
| Джерело. Для збільшення натисніть на світлину |
2. Спробуємо розібратись у правильності призначення цих засобів. Для цього на тому ж сайті DrugBank можна знайти розділ “structured indication”, що перекладається як “покази до застосування” і там буде зазначено, що амітриптілін призначається при різних психіатричних захворюваннях в тому числі і при депресії.
Також за ключовими словами “amitriptyline, fda, label” можна знайти інструкції до застосування у США та ознайомитись з нею.
У зв’язку з тим, що лікарські засоби, що містять umifenovir не зареєстровані в США/ЄС, ми не можемо скористатись таким пошуком і маємо (або не маємо) довіряти регуляторам СНГ.
| Як почати розбиратись, які ліки ефективні, а які ні? |
| Джерело. Для збільшення натисніть на світлину |
3. Окрім цього важливою є кількість наукових публікацій, бо науковий інтерес до фармакологічної речовини є хоч і не прямим, але опосередкованим свідченням ефективності.
Адже очевидно, що вчені та лікарі не будуть досліджувати лікарські засоби, які є не ефективними.
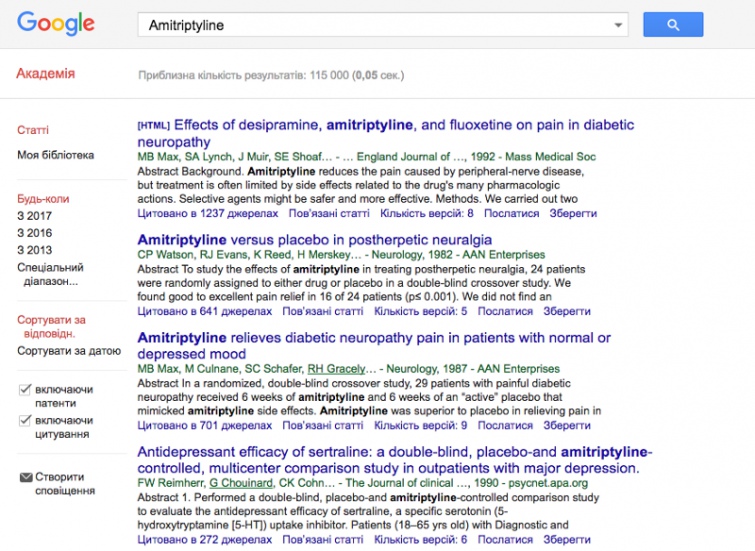
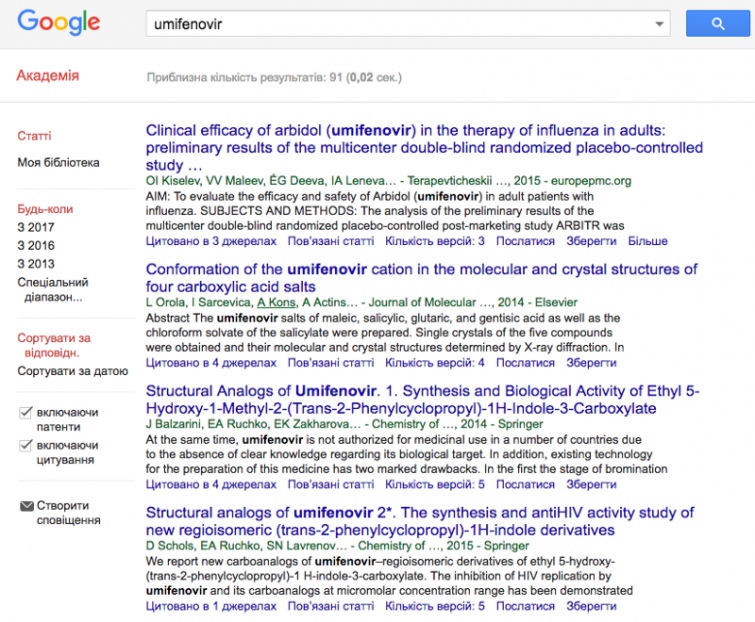
Для перевірки цього параметру можна скористуватися наукометричною базою PubMed, яка містить більше 8747 статей зі згадуванням “Amitriptyline”, інша ж науковометрична база Google Scholar містить 115000 згадування амітриптіліну.
В той самий час, за пошуком “umifenovir” PubMed дає 116 публікацій, а Google Scholar – 91.
 |
| Для збільшення натисніть на світлину |
 |
| Для збільшення натисніть на світлину |
Також необхідно звернути увагу, на те, що статті про амітриптілін написані багатонаціональними колективами вчених, надруковані в авторитетних рецензованих журналах і активно цитуються іншими вченими.
Про уміфеновір таке сказати не можна.
4. Спробуємо розібратись з клінічними дослідженнями.
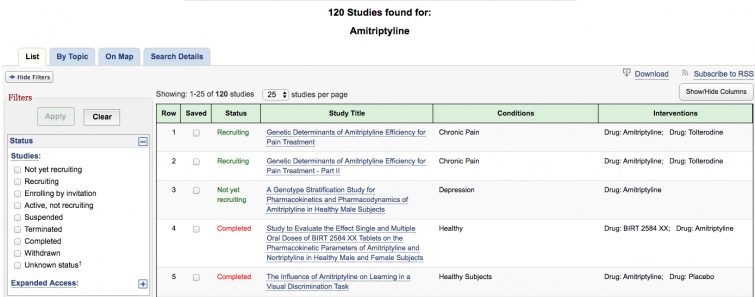
За допомогою сайту www.clinicaltrials.gov, на якому розміщуються інформація про міжнародні клінічні дослідження можна дізнатися про 102 клінічних дослідження амітриптіліну. І вочевидь, якби амітриптілін був не ефективний або небезпечний, то дослідження зупинились би після декількох невдач.
Але ж ми бачимо, що дослідження продовжуються і вчені шукають нові показання до застосування.
В той же час було проведено лише 1 дослідження уміфеновіру, про що це свідчить я думаю ви розумієте.
 |
| Для збільшення натисніть на світлину |
5. Окрім цього можна звернутись до Всесвітньої організації охорони здоров’я, яка розробляє Орієнтовний перелік життєвонеобхідних лікарських засобів, що містить ліки з доведеною ефективністю та безпечністю, але додатково ще з урахування доцільності витрат для задоволення найбільш важливих потреб у системі охорони здоров’я.
Тому в цей перелік можуть не потрапити ефективні та високовартісні ліки. На основі цього переліку країни часто розробляють власні місцеві переліки в Україні це Національний перелік основних лікарських засобів.
Якщо їх відкрити, то можна дізнатись, що амітриптілін міститься і у Переліку ВООЗ і в Національному переліку, а уміфеновір – ні.
6. Окрім того, щоб не загубитись у великій кількості інформації існують систематичні огляди (review) – роботи з огляду низки опублікованих окремих однорідних оригінальних досліджень з метою їх критичного аналізу та оцінки.
Одним з найавторитетніших джерел таких оглядів є Кохранівська співпраця, що вивчає ефективність медичних засобів та методик.
Одним із обзорів стосується лікування депресії амітриптіліном і загальний висновок авторів полягає в тому, що він є ефективним у лікуванні депресії, але має більше побічних ефектів ніж деякі інші антидепресанти.
 |
| Ось що каже одне з найавторитетніших джерел оглядів ефективності преператів – Кохранівська співпраця. Джерело |
Результатів Кохранівського огляду ефективності лікування уміфеновіром грипу не було на момент публікації.
Підсумовуючи зазначу, що однозначно казати про ефективність лікарського засобу або її відсутність неможливо. Проте кожна інституція або людина можуть вивчити наявну інформацію і зробити для себе висновки.
Сподіваюсь, що інформація допоможе вам розібратись в ефективності та безпечності ліків, які ви або ваші родичі та друзі приймають.
В той же, час необхідно розуміти, що 15-хвилинна стаття не зробить з вас лікаря, тому використовуйте ці знання для того, щоб задавати питання, а не займатись самолікуванням.
Хочу зазначити, що особисто мені було б доволі важко відповісти на питання “А чому ви мені призначили препарат Х, який не застосовується в США/ЄС, не рекомендується ВООЗ, та не має міжнародних клінічних досліджень?”
Євгеній Гончар, сімейний лікар
